Del papel al soporte digital:
Una corta clase de historia
Hace años, los sistemas de calidad y los procesos regulados en la industria farmacéutica se regían en papel. Cuadernos de notas de laboratorio, carpetas de ensayos clínicos, recetas maestras, registros de lotes y procedimientos son algunos ejemplos de estos documentos escritos o impresos. Las firmas y fechas de tinta húmeda dieron una indicación clara sobre los detalles de aprobación.
Hoy en día, los procesos farmacéuticos completos se han digitalizado, lo que resulta en varias ventajas. Podemos encontrar datos más rápidamente, independientemente de dónde nos encontremos, hacer copias de seguridad y reunir datos de múltiples sistemas fuente para proporcionar nuevas perspectivas, por nombrar algunas ventajas. Sin embargo, nuestra sociedad digital también implica riesgos relacionados con la integridad de los datos. Ingresar datos en sistemas electrónicos implica el riesgo de errores humanos. Además, resulta más difícil determinar los documentos originales, ya que el envío por correo electrónico, la descarga, la carga y el intercambio de documentos es una práctica común. En resumen, la digitalización actual requiere un enfoque diferente de la integridad de los datos.
La importancia de la integridad de los datos
Pero, ¿por qué la integridad de los datos es tan importante? En un informe especial sobre integridad de datos, Pharmaceutical Engineering® enumera tres puntos clave (1).
- En primer lugar, las agencias reguladoras y las empresas necesitan datos precisos y confiables para garantizar la seguridad, la eficacia y la calidad de un producto. Esto es especialmente importante en el caso de los medicamentos, para garantizar la seguridad y la salud de los pacientes.
- En segundo lugar, la integridad de los datos es crucial para garantizar la confianza entre la industria y las agencias reguladoras. En caso de problemas de integridad de datos, las agencias reguladoras no pueden garantizar la calidad de los productos.
- Y, por último, las agencias reguladoras no pueden auditar constantemente a las empresas para inspeccionar cada pequeño detalle de los procesos y la producción. Las agencias confían en una organización para hacer lo correcto y garantizar la calidad de los productos y procesos. En resumen, los datos deben ser completos, consistentes y precisos.
2016 parecía ser el año de la integridad de los datos, ya que tanto la Administración de Alimentos y Medicamentos (FDA) como la Agencia Europea de Medicamentos (EMA) publicaron una nueva guía de integridad de datos. Sin embargo, la integridad de los datos es más que solo una palabra de moda.
Para las compañías farmacéuticas, pero también para otras industrias fuertemente reguladas como fabricantes de dispositivos médicos de diagnóstico, biotecnología o alimentos, la integridad de datos es crucial para garantizar la calidad y eficacia del producto. Aunque las directrices de la FDA y EMA son ‘recomendaciones no vinculantes’, no podemos ignorar el hecho de que la integridad de los datos es un tema importante durante las auditorías e inspecciones en la industria farmacéutica.
Este documento técnico trata las preguntas más comunes sobre la integridad de los datos. ¿Qué es integridad de datos? por que es tan importante? ¿Y cómo aseguran el cumplimiento las compañías farmacéuticas y de ciencias de la vida? ¡Miremos más de cerca!
Integridad de los datos en la industria farmacéutica : una breve descripción
La industria farmacéutica y la integridad de los datos.
En la industria farmacéutica, de la salud y dispositivos médicos, el paciente es el centro. Es por eso que los gobiernos y la industria están preocupados por la salud, bienestar y seguridad del paciente.
La integridad de los datos juega un papel importante en este caso, por ejemplo, en los estudios clínicos, cuando los datos sobre los sujetos se envían a la organización que realiza la investigación a través de varios dispositivos y sistemas. Si la información es incorrecta, por ejemplo porque los datos sobre los efectos secundarios han desaparecido o se han transferido incorrectamente, esto puede tener consecuencias importantes, que van desde desagradable a fatal. Además, los problemas con la integridad de los datos no solo pueden provocar daños al paciente, sino también en retiros de productos, incumplimiento normativo y problemas de imagen de la empresa.
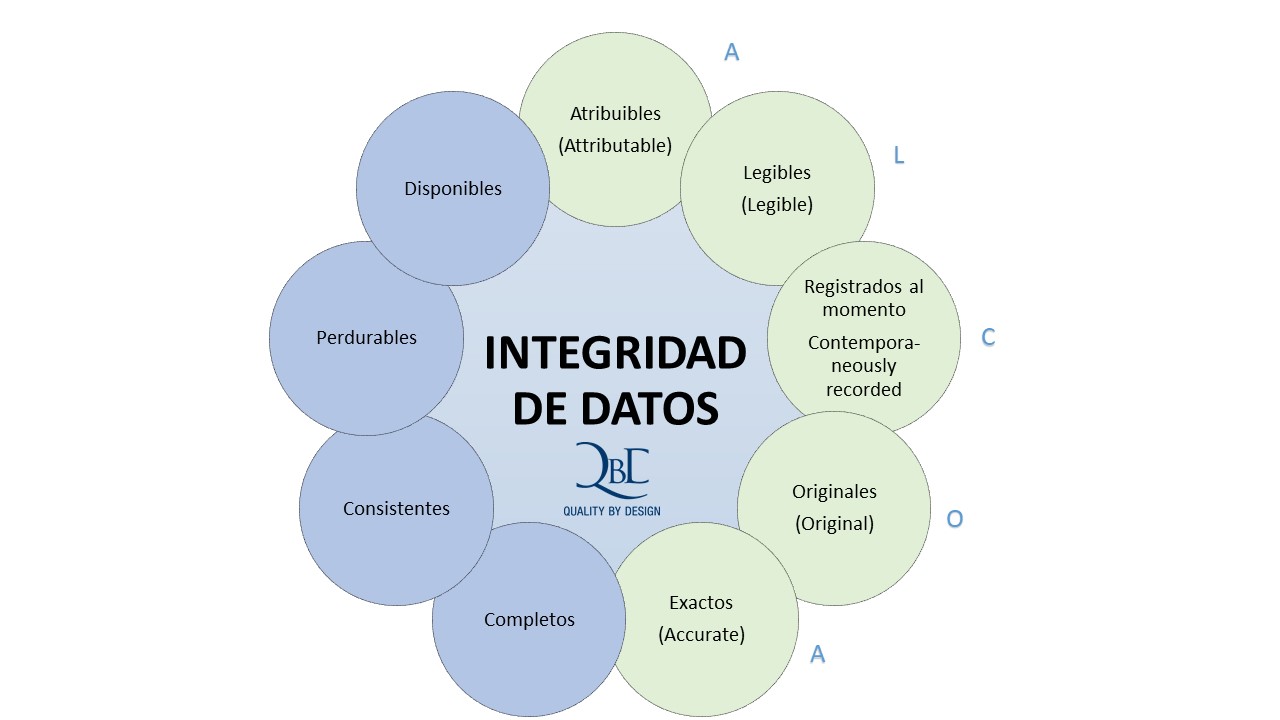
ALCOA
¿Cómo garantizan las compañías la integridad de los datos? Según la FDA, ALCOA es un marco importante para ayudar a las empresas a lograr la integridad de los datos. ALCOA es aplicable tanto a datos impresos como electrónicos y debe ser parte del ciclo de vida de datos de una organización y de la Buena práctica de documentación (GDP). Significa que los datos deberían ser:
- Atribuible (ALCOA) Al crear un registro, las empresas necesitan saber quién lo creó, cuándo y por qué. En otras palabras, todos los datos deben ser atribuibles a la persona que los generó. Por ejemplo, a través de una inicial, firma y / o fecha en un registro en papel. Cuando se usa un sistema electrónico, es importante implementar una funcionalidad en el sistema de su computadora para dejar en claro cómo y cuándo una determinada persona llevó a cabo una acción o algo aprobado, por ejemplo, utilizando una identificación de usuario y contraseña únicas para cada usuario. No se recomienda el uso de inicios de sesión similares que no pueden diferenciar entre diferentes personas. La validación de los sistemas computarizados es muy importante en este asunto, para evitar el fraude con los identificadores de usuario y garantizar la integridad de los datos electrónicos.
- Legible (ALCOA) Incluso en la era digital, los datos legibles no siempre son evidentes. Para optimizar el acceso a los datos a lo largo de su ciclo de vida, es importante asegurarse de que los registros sean legibles y permanentes. Este es también el caso para el almacenamiento de metadatos legibles por humanos que pueden registrarse para soportar un registro electrónico. No olvide tampoco los registros en papel, también deben controlarse para evitar la recreación no autorizada.
- Contemporáneas (ALCOA) Las empresas necesitan registrar datos o mediciones en el momento en que se realiza el trabajo, por ejemplo, utilizando el tiempo del servidor de una organización reconocida y agregando el huso horario correcto. En caso de papeleo, los sellos de fecha y hora deben estar en orden de ejecución. Además, nunca debes retroceder datos. El diseño del sistema es un factor importante para garantizar el mantenimiento de registros contemporáneos. Garantiza a los empleados la disponibilidad de registros en el lugar correcto en el momento adecuado, para que no se arriesguen a perder documentos o tengan que retener información para completar registros oficiales más adelante.
- Originales (ALCOA) también se conocen como datos de origen o datos primarios. Es el medio en el que se registra el punto de datos por primera vez, por ejemplo, una base de datos o un cuaderno. Dado que es difícil distinguir documentos originales de sus copias, es importante identificar los registros originales de la copia fiel certificada. Una vez más, los metadatos sobre quién completó una actividad, dónde y cuándo son importantes.
- Exactos (ALCOA) Por supuesto, los datos no pueden contener ningún error, que incluye errores humanos y automáticos. Deben estar libres de errores, y también ser completos, veraces y que reflejen la observación. Si alguien edita los datos, siempre debe documentar los cambios y anotar las modificaciones, con ayuda de una auditoría de rastreo (Audit trail). Una auditoría de rastreo se puede definir como: “Datos en forma de una ruta lógica que vincula una secuencia de eventos, utilizada para rastrear las transacciones que han afectado el contenido de un registro”. (ISO)
“Según la FDA,” ALCOA “es un marco importante para ayudar a las empresas a lograr la integridad de los datos. “
Enfoque basado en el riesgo
Enfóquese en lo que realmente importa, para garantizar la integridad de los datos y la calidad de los productos, el gobierno inspecciona las organizaciones y lleva a cabo auditorías anunciadas y no anunciadas. De esta forma, es posible verificar al azar si una organización cumple con todos los requisitos a lo largo del ciclo de vida de los datos. Sin embargo, no es posible controlar la producción de medicamentos u otros productos médicos al cien por cien, sin controlar cada parte de una línea de producción, todos los días, en todas las organizaciones del mundo. Es por eso que debe generar calidad e integridad de datos en sus procesos. En este asunto, es importante utilizar un enfoque de validación basado en el riesgo.
Las organizaciones suelen luchar por encontrar un equilibrio entre cumplir y ahogarse en costos y pérdida de tiempo. Un enfoque pragmático basado en los riesgos, basado en las mejores prácticas de la industria, como Science Based Risk Management (GAMP 5 ® (ISPE)), ayuda a centrarse en la calidad del producto y la seguridad del paciente, a la vez que reduce el costo de la validación. Paso importante en el enfoque de integridad de datos basado en riesgo, es analizar la brecha de integridad de datos. Esto incluye mirar de cerca todos los dispositivos, sistemas y programas de computadora: ¿cumplen con el marco de ALCOA? Posteriormente, puede enumerar todos los vacíos, analizarlos y evaluar cuál es el más urgente con respecto a sus riesgos.
Integridad de los datos y calidad de los datos : las diferencias
Para las empresas farmacéuticas, se requieren la integridad de datos y calidad de datos. Sin embargo, los dos conceptos no son lo mismo:
- La integridad de los datos se centra en proporcionar un valor confiable para los usuarios.
- La calidad de datos mide los atributos alrededor de sus valores. Permite a las personas clasificar, buscar y filtrar valores de manera eficiente, según la Sociedad Internacional de Ingeniería Farmacéutica (ISPE).
La integridad de datos es un concepto amplio, que abarca desde la rastreabilidad de datos de origen hasta su seguridad. La calidad de los datos es la medida en que son adecuados y válidos como fuente de información para procesos de decisión operacionales o estratégicos. La integridad de los datos contribuye a mejorar su calidad, pero ésta no garantiza en automático la integridad.
Hoja de ruta para las empresas para las compañías farmacéuticas.
La gestión de la integridad de los datos es importante para seguir siendo un negocio viable. Además de consultar a una empresa profesional con experiencia, se requiere iniciar un programa de integridad de datos. Esto consiste en varios pasos.
- Antes que nada, es importante que la administración se dé cuenta de la importancia de la integridad de los datos. El liderazgo y la cultura organizacional de una empresa pueden tener efectos positivos en la integridad de los datos.
- Comience a definir los datos críticos dentro de una organización. Esto es importante tanto para el gobierno como para la compañía en sí. Una vez definido, debe pesar los datos y asignarle un ciclo de vida. En otras palabras, ¿cuánto tiempo circularán los datos dentro de una organización?
- Investigación adicional del ciclo de vida de los datos dentro de la organización. ¿Cuál es el flujo del proceso? ¿A dónde van los datos? ¿Dónde están almacenados? ¿Están manejados por un programa de computadora? Es importante traducir sus datos en algún tipo de atlas o mapa para ver cómo fluyen dentro de su organización.
- Asegúrese de investigar los riesgos en el flujo de su proceso, incluidas personas, documentos y los sistemas informáticos. Actúe de manera inteligente y haga uso del sistema de calidad de su organización. Los errores registrados en su sistema de calidad son una valiosa fuente de información para investigar los riesgos más importantes.
MÉTRICAS
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) enumera algunas métricas que ayudarán a identificar oportunidades de mejora:
- Seguimiento y tendencia de datos inválidos e inusuales para revelar variabilidad imprevista y oportunidades de mejora en procesos y procedimientos.
- Revisión de auditorías de rastreo para revelar el procesamiento e informe de datos incorrecto identificando la necesidad de capacitación adicional.
- Auditorías de rutina y/o autoinspecciones a sistemas computarizados revelan brechas en controles de seguridad que inadvertidamente permitan el acceso y potencialmente alteren los sellos de fecha y hora.
- Monitorear a los contratistas, revisar tendencias de las métricas de calidad asociadas con ellos a fin de identificar riesgos que puedan indicar la necesidad de un compromiso más activo y la asignación de recursos adicionales por parte del contratista para garantizar que se cumplan los estándares de calidad.
- Si conoce sus errores y riesgos, puede tomar medidas para evitar lo peor. Ajustando procedimientos, reemplazando programas de computadora o empleando nuevas personas para aliviar la carga de trabajo en la organización.
- Al inventariar los flujos de datos, verá en qué punto del proceso puede recopilar métricas que ayuden a controlar la calidad e integridad de datos. Las organizaciones deben monitorear estos aspectos críticos continuamente, para ver si algo sale mal e interferir a tiempo. Es crucial construir puntos de control en cada fase del ciclo de vida.
Integridad de datos y su organización: consejos y trucos
“Garantizar la integridad de los datos afecta a organización completa, durante todo el ciclo de vida del producto”. Ya sea deliberado o por accidente, siempre existe el riesgo de errores humanos cometidos por los empleados durante este proceso. Esto puede influir incluso en los sistemas de calidad más completos de una organización. Por eso un buen liderazgo y una cultura empresarial bien organizada son cruciales para optimizar la integridad de los datos. Y, según ISO 9001: 2015, hay un papel importante para la gestión de las organizaciones.
Entre otros, la gerencia debe garantizar suficientes empleados competentes, proporcionar equipo sólido y adecuado para realizar tareas y mantener las instalaciones, garantizando que el entorno operativo se mantiene en buen estado. Además, una organización debe centrarse en garantizar la integridad de los datos en todos los aspectos. Debe utilizar sistemas que puedan llevar a cabo las inspecciones esenciales para garantizar la integridad de los datos. Además, se deben implementar buenos procesos de revisión para detectar problemas de integridad.
La MHRA enumera algunos requisitos básicos para que las organizaciones garanticen la integridad de los datos, que incluyen (3):
- Acceso a relojes para registrar eventos programados.
- Accesibilidad de registros de lotes en lugares donde se realizan actividades para evitar la transcripción posterior a registros oficiales.
- Control sobre plantillas de papel en blanco para el registro de datos.
- Derechos de acceso de usuario que previenen ( o rastro de auditoría) enmiendas de datos.
- Captura de datos automatizada o impresoras conectadas a equipos como balanzas.
- Proximidad de impresoras a actividades relevantes.
- Acceso a puntos de muestreo (por ejemplo, para sistemas de agua).
- Acceso a datos sin procesar para el personal que realiza actividades de verificación de datos.
ALCOA es un marco importante para ayudar a las empresas a lograr la integridad de los datos.
1. Sociedad internacional de ingeniería farmacéutica , ‘ Ingeniería farmacéutica, Integridad de datos de informes especiales’ (36) 2016, n. ° 2, p. 41.
2. Sociedad internacional de ingeniería farmacéutica, ‘Ingeniería farmacéutica, Integridad de datos de informes especiales’ (36) 2016, n. ° 2, p. 42.
3. Agencia Reguladora de Medicamentos y Productos Sanitarios, ‘Definiciones y Orientaciones de Integridad de Datos de MHMP GMP para la Industria, marzo de 2015’.
¿Necesita ayuda con la INTEGRIDAD DE DATOS?
Contáctenos con los detalles de su proyecto
QbD ayuda a gestionar eficientemente la integridad de datos de su empresa tanto en sistemas globales como locales.
¡Recuerda! En www.qbd.lat te podemos ayudar con:
Validación de Sistemas Computarizados Validación de Procesos | Validación de Limpieza | Validación de hojas de cálculo | Cualificación de Equipos | Cualificación de Sistemas de Apoyo Crítico (HVAC) | Evaluación clínica, regulatoria y Validación de Medical Devices | Data Integrity |
Contáctanos en:
Norteamérica: (+55) 5516 6646
Suramérica: (+57) 350-8886031
Europa: (+34) 655 591 603
¡Síguenos en nuestras redes!